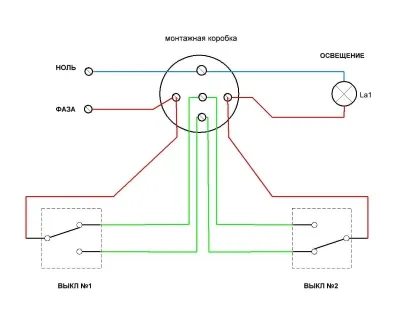
Например, хлорид алюминия реагирует с водным раствором аммиака с образованием гидроксида алюминия и хлорида аммония:
Алюминий

Алюминий — это белый, ковкий и легкий металл с серебристым матовым оксидным слоем. В периодической таблице Менделеева этот химический элемент называется Al (алюминий) и относится к главной подгруппе III группы, III периода, с атомным номером 13. Купить алюминий вы можете на нашем сайте.
В 16 веке Парацельс сделал первый шаг к получению алюминия. Он выделил «глинозем» из квасцов, которые содержали оксид неизвестного тогда металла. В XVIII веке немецкий химик Андреас Маргграф снова взялся за этот эксперимент. Он назвал оксид алюминия «alumina», что в переводе с латинского означает «глинозем». В то время этот металл был не очень популярен, поскольку его нельзя было найти в чистом виде. В течение многих лет британские, датские и немецкие ученые пытались выделить чистый алюминий. На Всемирной выставке в Париже в 1855 году металлический алюминий произвел фурор. Поскольку металл был довольно дорогим, из него изготавливали только предметы роскоши и ювелирные изделия. В конце 19 века появился более современный и дешевый метод производства алюминия. В 1911 году в Дюрене была произведена первая партия дюралюминия, названного в честь города. В 1919 году из этого материала был изготовлен первый самолет.
Физические свойства
Металлический алюминий характеризуется высокой электро- и теплопроводностью, коррозионной и морозостойкостью, а также гибкостью. Его можно хорошо уплотнять, ковать, тянуть и прокатывать. Алюминий хорошо сваривается с помощью различных сварочных процессов. Важным свойством является его низкая плотность — около 2,7 г/см³. Температура его плавления составляет 660°C. Механические, физико-химические и технологические свойства алюминия зависят от наличия и количества примесей, которые снижают свойства чистого металла. Основными физическими примесями являются кремний, железо, цинк, титан и медь.
Различают алюминий высокой чистоты и технический алюминий. Практическая разница заключается в различной коррозионной стойкости в определенных средах. Чем чище металл, тем он дороже. Технический алюминий используется для производства сплавов, проката и кабелей. Высокочистый металл используется для специальных целей. По электропроводности алюминий уступает только золоту, серебру и меди. Сочетание низкой плотности и высокой электропроводности делает его конкурентоспособным по сравнению с медью в проводке и кабелях. Длительный отжиг улучшает электропроводность, отжиг ухудшает ее.
Теплопроводность алюминия увеличивается по мере повышения чистоты металла. Примеси марганца, магния и меди снижают это свойство. Алюминий обладает второй по величине теплопроводностью после меди и серебра. Благодаря этому свойству металл используется в теплообменниках и холодильниках. Алюминий обладает высокой удельной теплоемкостью и высокой температурой плавления. Эти значения намного выше, чем у большинства металлов. Чем выше чистота алюминия, тем больше света может отражаться от его поверхности. Металл хорошо отполирован и анодирован.
Алюминий имеет высокое сродство к кислороду и при контакте с воздухом покрывается тонкой, твердой пленкой оксида алюминия. Эта пленка защищает металл от последующего окисления и придает ему хорошие антикоррозионные свойства. Алюминий устойчив к атмосферной коррозии, соленой и пресной воде и практически не взаимодействует с органическими кислотами и концентрированной или разбавленной азотной кислотой.
Химические свойства
Алюминий является достаточно активным амфотерным металлом. В нормальных условиях прочный оксидный слой определяет прочность материала. Когда оксидный слой разрушается, алюминий выступает в качестве активного восстановительного металла. Металл реагирует с кислородом в тонком состоянии и при высокой температуре. При нагревании он вступает в реакцию с серой, фосфором, азотом, углеродом и йодом. В нормальных условиях металл реагирует с хлором и бромом. Он не реагирует с водородом. Алюминий образует сплавы с металлами, содержащие интерметаллические соединения — алюминиды.
Когда оксидный слой очищается, он вступает в сильную реакцию с водой. Реакции с разбавленными кислотами просты. При нагревании происходят реакции с концентрированными азотной и серной кислотами. Алюминий легко вступает в реакцию со щелочами. Его способность восстанавливать металлы из оксидов и солей — глиноземные реакции — нашла практическое применение в металлургии.
Содержание
- 1 История
- 2 Получение
- 2.1 В лабораторных условиях
- 7.1 В качестве восстановителя
- 7.2 Сплавы на основе алюминия
- 7.3 Алюминий как добавка в другие сплавы
- 7.4 Ювелирные изделия
- 7.5 Стекловарение
- 7.6 Пищевая промышленность
- 7.7 Алюминий и его соединения в ракетной технике
- 8.1 В произведениях эпохи знакомства человечества с алюминием
Впервые алюминий был получен в 1825 году датским физиком Хансом Эрстедом путем воздействия амальгамы калия на хлорид алюминия, а затем путем дистилляции ртути. Название элемента происходит от латинского aluminis — глина.
Получить
Современный процесс производства был разработан независимо друг от друга американцем Чарльзом Холлом и французом Полем Герольтом в 1886 году. Она заключается в растворении оксида алюминия Al2O3в расплавленном криолите Na3AlF6с последующим электролизом с использованием расходуемых электродов из кокса или графита. Этот способ производства требует большого количества электроэнергии и поэтому оказался востребованным только в 20 веке.
Для производства 1 000 кг сырого алюминия требуется 1 920 кг глинозема, 65 кг криолита, 35 кг фторида алюминия, 600 кг анодной массы и 17 000 кВт/ч постоянного тока. 2
В лабораторных условиях
Согласно статье в Википедии, здесь должен быть создан специальный раздел. Вы можете поддержать проект, написав этот раздел.
Лабораторный процесс производства алюминия был предложен Фридрихом Вёлером в 1827 году.AlCl3+3K → 3KCl + Al(реакция происходит при нагревании металла).
Физические свойства


Микроструктура алюминия на протравленной поверхности слитка чистотой 99,9998 %, с видимым размером сектора около 55 × 37 мм.
- Металл серебристо-белого цвета, лёгкий
- плотность — 2,7 г/см³
- температура плавления у технического алюминия — 658 °C, у алюминия высокой чистоты — 660 °C
- удельная теплота плавления — 390 кДж/кг
- температура кипения — 2500 °C
- удельная теплота испарения — 10,53 МДж/кг
- временное сопротивление литого алюминия — 10-12 кг/мм², деформируемого — 18-25 кг/мм², сплавов — 38-42 кг/мм²
- Твёрдостьпо Бринеллю — 24…32 кгс/мм²
- высокая пластичность: у технического — 35 %, у чистого — 50 %, прокатывается в тонкий лист и даже фольгу
- Модуль Юнга — 70 ГПа
- Алюминий обладает высокой электропроводностью (37·10 6 См/м) и теплопроводностью (203,5 Вт/(м·К)), 65 % от электропроводности меди, обладает высокой светоотражательной способностью.
- Слабый парамагнетик.
- Температурный коэффициент линейного расширения 24,58·10 −6 К −1 (20…200 °C).
- Температурный коэффициент электрического сопротивления 2,7·10 −8 K −1.
Алюминий образует сплавы почти со всеми металлами. Наиболее известными являются сплавы с медью и магнием (дюралюминий) и кремнием (силумин).
Как был открыт
Боксит и глинозем известны человеку уже много веков. Только в середине 19 века они узнали об алюминии как о металле.
Мировой опыт
История его открытия — это история одиноких экспериментов ученых:
- Первую попытку предпринял Парацельс (XVI век). Он выделил из квасцов «квасцовую землю», содержащую оксид неизвестного металла (алюминия).
- Два века спустя процесс повторил немецкий химик Андреас Маргграф. Тоже получил оксид металла, которому присвоил название alumina («вяжущий»).
- Первые миллиграммы металла выделил датчанин Ганс Эрстед. Физик-практик выбрал исходником хлорид алюминия. Нагревая и воздействуя калийной амальгамой, получил чистый металл.
- Чистый калий, а не амальгаму использовал Фридрих Велер. Восстановив металл (получилось несколько крупинок), описал его свойства.
- Еще дальше пошел француз Сент-Клер Девиль. Он изготовил слиток металла, использовав метод Велера. Но вместо калия взял натрий. Девиль предъявил слиток публике на Всемирной выставке в Париже (1855 год), сотворив сенсацию. Спустя год получил металл методом электролиза. Такой успех объясним: ученого спонсировал сам Наполеон III, рассчитывавший приспособить металл для военных нужд.
Американцу Чарльзу Холлу и французу Полю Геру принадлежит заслуга в извлечении металла промышленными партиями. Независимо друг от друга, к 1886 году они разработали метод переплавки глинозема в криолит путем электролиза.
Металл в России
Российские ученые также экспериментировали с глиноземом. Метод, предложенный К. И. Байером, стал классическим для мировой глиноземной промышленности.
Первый алюминиевый завод — Волховский алюминиевый литейный завод — был введен в эксплуатацию в советский период (1932 год).
Производство сырья составило тысячи тонн. Эта отрасль имела особое значение, поскольку ее продукция обеспечивала обороноспособность государства.
Сегодня компания «Русал» («Русский алюминий») обладает монополией на добычу и переработку сырья.
Новое «золото»
Первый алюминий был дороже золота:
- Европейская знать использовала алюминиевые столовые приборы (гостям попроще выдавались серебряные или золотые). Моду задал своим указом император Франции Наполеон III.
- Ювелиры изготавливали украшения класса люкс.
- Бесценный подарок сделали англичане русскому гению Дмитрию Менделееву – весы с чашами из золота и алюминия.
В начале двадцатого века появился дешевый метод. В 1911 году в Дюрене, Франция, была произведена первая партия металла. Он был назван в честь этого города. А алюминий перешел в разряд ювелирных изделий.
История названия
Латинский термин происходит от корня alumen и является названием квасцов, которые использовались целителями с древних времен.
В России металл называли «серебряной глиной», поскольку глинозем является основным компонентом глины.
Металл в природе
7,4-8,1 % земной коры состоит из алюминия. В природе он содержится в горных породах и минералах, образующих земную кору.
Почти всегда это соединения алюминия:
- Бокситы (оксиды с примесью кремния, кальция, железа).
- Глиноземы (каолиново-песчаная либо известковая, магнезиальная смесь).
- Нефелины (с калием).
- Каолиниты.
- Корунды.
В корунде сосуществуют «твердый» изумруд и минералы сапфир и рубин, которые являются драгоценными камнями. Их решетчатые структуры идентичны.
Соединения алюминия были обнаружены в воде рек, морей и океанов. В чистом виде он встречается только в жерлах вулканов.
Месторождения и методы добычи
Основным сырьем для производства алюминия является боксит. Месторождения сосредоточены в тропических и субтропических регионах.

Россия богата нефелиновыми рудами, которые поступают с севера страны (Кольский полуостров и Кемеровская область).
Мировые запасы нефритовой руды составляют миллионы тонн.
Они добываются открытым или подземным способом.
Соли алюминия
Нитрат и сульфат алюминия
Нитрат алюминия при нагревании разлагается на оксид алюминия, оксид азота (IV) и кислород:
Сульфат алюминия разлагается на оксид алюминия, диоксид серы и кислород:
Комплексные соли алюминия
Для описания свойств комплексных солей алюминия — гидроксиалюминатов алюминия — полезен следующий метод: Тетрагидроксиалюминат мысленно распадается на две отдельные молекулы — гидроксид алюминия и гидроксид щелочи.
Например, мы разделили тетрагидроксиалюминат натрия на гидроксид алюминия и гидроксид натрия:
NaAl(OH)4NaOH и Al(OH)3
Свойства всего комплекса могут быть определены как свойства этих отдельных соединений.
Таким образом, гидроксильные комплексы алюминия реагируют с кислотными оксидами.
Например, гидроксильный комплекс разлагается под действием избытка углекислого газа. В то же время он вступает в реакцию с CO2реагирует с NaOH с образованием кислой соли (в избытке CO2), тогда как амфотерный гидроксид алюминия не реагирует с углекислым газом и поэтому просто выпадает в осадок:
Тетрагидроксиалюминат калия аналогично реагирует с углекислым газом:
По тому же принципу тетрагидроксиалюминаты реагируют с диоксидом серы SO.2:
Однако осадок не выпадает под воздействием избытка сильной кислоты, поскольку амфотерный гидроксид алюминия реагирует с сильными кислотами.
Например, с соляной кислотой:
Однако при воздействии небольшого количества (недостаточно) сильной кислоты осадок все равно выпадает в осадок; кислоты недостаточно для растворения гидроксида алюминия:
Аналогичным образом, гидроксид алюминия выпадает в осадок в отсутствие азотной кислоты:
Комплекс разлагается при контакте с водой, содержащей хлор (водный раствор хлора) Cl2:
Хлор присутствует в этом процессе в непропорционально большом количестве.
Комплекс также может реагировать с избытком хлорида алюминия. Выпадает осадок гидроксида алюминия:
Если из раствора соли выпарить воду и нагреть полученное вещество, то останется обычная алюминиевая соль:
Гидролиз солей алюминия
Растворимые соли алюминия и сильные кислоты гидролизуются до катиона. Гидролиз протекает поэтапно и является обратимым, т.е. незначительно:
Стадия I: Al 3+ + H2O = AlOH 2+ + H +
Стадия II: AlOH 2+ + H2O = Al(OH )2+ + H +
Однако сульфиды, сульфаты, карбонаты алюминия и их кислые соли полностью и необратимо гидролизуются, т.е. они не существуют в водном растворе, а разлагаются в воде:
Для получения дополнительной информации о гидролизе см. соответствующую статью.
Алюминаты
Соли, в которых алюминий является кислотным остатком (соли алюминия) — образуются из оксида алюминия при сплавлении со щелочами и основными оксидами:
Как искали неизвестный алюминий
История открытия алюминия уходит корнями в глубокую древность. Плиний писал о квасцах (alumen), но под квасцами они подразумевали разные вещества. Это сурьма, винный камень, щелочь и гипс.
Лавуазье сделал логичное наблюдение: глинозем является оксидом неизвестного металла. Затем были мобилизованы химики, чтобы попытаться «выследить» неизвестный металл. Было предпринято множество попыток, но только в 1825 году датчанину Эрстеду удалось получить неизвестный металл, напоминающий олово. Он назывался алюминий.
Свойства крылатого металла
В периодической таблице Менделеева алюминий имеет несчастливый номер 13, но это никак не повлияло на счастливую судьбу металла.

Этот легкий серебристый металл легко обрабатывается и отливается, он очень пластичен.
Его редкая способность быстро образовывать оксидные пленки на поверхности чистого металла. Однако эти пленки не обеспечивают достаточной защиты от коррозии. Химическое и электрохимическое окисление более надежно. Тип оксидной пленки — A12Oz.
Химические и физические свойства алюминия:
- плотность 2,7 г/см3;
- температура плавления 660°С;
- кипит цветной металл при температуре 2518°С;
- строение кристаллической решетки гранецентрированное, кубическое;
- степени окисления 0; +3.
При использовании металлического алюминия (взаимодействие с оксидами металлов) образуются металлы, которые трудно восстановить. Этот метод называется алюминотермической обработкой.
У алюминия есть стабильный изотоп — 27Al.

Микроструктура алюминия на протравленной поверхности слитка чистотой 99,9998 %, с видимым размером сектора около 55 × 37 мм.
Неправда, но хорошо придумано
В печатных СМИ, а теперь и в Интернете, появились сообщения о фермере, который вел «горячие дискуссии о полете на Луну». Крестьянин (или гражданин), по одним данным Петров, по другим — Никифоров, был сослан в село Байконур в Кыргызстане» Утверждается, что новость об этом событии была напечатана в «Московских губернских ведомостях» в 1848 году. Сейчас, когда с космодрома Байконур в космос отправились более десятка спутников и станций, это событие кажется пророческим и мистическим.
Только это неправда. Внимательные читатели просмотрели все файлы этой газеты и не нашли такой заметки. Это просто красивая легенда.
Алюминиевые сплавы, плюсы и минусы

Кодовый символ, указывающий на то, что алюминий может быть переработан
Использовать чистый алюминий в строительстве не имеет смысла. Его прочностные характеристики «умеренные». Но алюминиевые сплавы — это совсем другое дело. Сегодня известно и используется около 60 сплавов. Можно выбрать для любой цели, на любой вкус.
Сплавы классифицируются на основе состава, свойств и способности к термообработке.
Добавки меди, магния, марганца и цинка значительно улучшают свойства сплава по сравнению с чистым металлом. Эти металлы являются наиболее распространенными легирующими компонентами для алюминия. Титан, литий, ванадий, цирий, скандий и некоторые редкие земли используются реже, но их свойства также востребованы в промышленности.
Дюраль
Дюралюминий — это сплав алюминия с медью (4 %), магнием (0,5 %) и небольшим количеством железа, марганца и кремния. Недостатком дюралюминия является его подверженность коррозии, которая смягчается анодированием, покрытием, грунтовкой и покраской.
Востребованные свойства сплава включают хорошую статическую и усталостную прочность и высокую вязкость разрушения.
Использование легкого и прочного металла важно не только в авиации.

Сапфир используется для изготовления пуленепробиваемых и бронированных стекол, а также экранов смартфонов. Это стекло обладает высокой прочностью на сжатие.
Интересно, что ученые продолжают разрабатывать пуленепробиваемые, но более тонкие и легкие виды стекла. Перспективной разработкой считается прозрачный экран на основе монокристаллического сапфира.
Алюминий используется для изготовления алюминиевой фольги для использования в электрических конденсаторах. Домохозяйки любят запекать угощения для семьи в фольге. Из «крылатого металла» изготавливают кастрюли, сковородки и другие предметы домашнего обихода.

Тонко измельченный металлический порошок используется для изготовления прочных красок.
Вы удивитесь, но алюминиевая кастрюля на кухне, самолет и кольцо с сапфиром связаны между собой. В каждом из них есть свой герой.
Удивительно, что треть железнодорожного транспорта является самоходным. Вес загруженного грузового вагона составляет треть от веса вагона. Не говоря уже о легковых автомобилях, где вес пассажиров составляет всего 5%, остальное — вес транспортного средства.
Оксид алюминия — это корунд. К ним относятся сапфиры, рубины и изумруды — драгоценные камни, содержащие алюминий. Сам корунд используется в качестве наждака.
Алюминий
Алюминий — самый распространенный металл в земной коре. Алюминий может активно использоваться в стальных конструкциях благодаря своим свойствам: Она легкая, мягкая, поддается ковке и обладает высокой коррозионной стойкостью.
Алюминий характеризуется высокой химической активностью и обладает высокой электро- и теплопроводностью.

Основное и возбужденное состояния
Когда атом алюминия переходит в возбужденное состояние, 2 электрона s-подуровня испаряются, а один электрон переходит в p-подуровень.
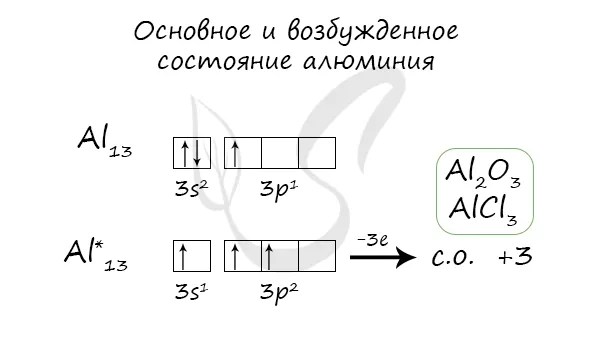
Физические соединения
- Al2O3— корунд
- 3BeO*Al2O3*6SiO2— Бериллий (аквамарин — примеси Fe и изумруд — примеси Cr)2O3)
- Al2O3*Cr2O3— красный рубин
- Al2O3с примесью Fe +2 /Fe +3 /Ti
- Al2O3*H2O — боксит

Получить
Алюминий производится путем электролиза расплавленного Al2O3в криолите (Na3AlF6Галлий, индий и таллий аналогичным образом получают электролизом их оксидов и солей.
Химические свойства
Реагирует с галогенами (кроме фтора) и кислородом при комнатной температуре с образованием оксидного слоя.
Al + Br2→ AlBr3(бромид алюминия)
При нагревании алюминий вступает в реакцию с фтором, серой, азотом и углеродом.
Al + F2→ (t) AlF3(фторид алюминия)
Al + S → (t) Al2S3(сульфид алюминия)
Al + N2→ (t) AlN (нитрид алюминия)
Al + C → (t) Al4C3(карбид алюминия)

Алюминий является амфотерным (в переводе с греческого «оба» — двойной) и реагирует как с кислотами, так и с основаниями.
Al + NaOH + H2O → NaAl(OH)4+ H2↑ (тетрагидроксиалюминат натрия; при получении чистого алюминия выделяется водород).
При кальцинировании образуются не комплексные соли, так как вода испаряется, а (в рамках ЕГЭ) средние соли — глинистые соли (академически — сложные оксиды):
При комнатной температуре он не работает из-за образования оксидного слоя — Al2O3— в воздухе. Если оксидный слой разрушен нагреванием щелочного раствора или амальгамированием (покрытие металла слоем ртути), реакция продолжается.

Алюминотермия (лат. aluminium + греч. therme — тепло) — процесс производства металлов и неметаллов, включающий восстановление их оксидов с помощью алюминия. Процесс может достигать температуры до 2400°C.
Термализм алюминия используется для получения Fe, Cr, Mn, Ca, Ti, V и W.

Оксид алюминия
Оксид алюминия образуется в результате реакции с кислородом — на воздухе алюминий покрывается оксидным слоем. При нагревании гидроксид алюминия легко разлагается на оксид и воду как нерастворимое основание.
Выводы о химических свойствах алюминия
Химические свойства алюминия полностью подтверждаются электронной структурой его атома. Обладая большим атомным радиусом и низким сродством к электрону, он может выступать в качестве сильного восстановителя, как и все активные металлы. Этот металл очень реакционноспособен, что делает его хорошим катализатором для некоторых химических реакций.
Известно также, что он увеличивает взрывную силу аммиачной селитры. Эти свойства лежат в основе использования алюминия, например, в фейерверках, где он заменяет более дорогой и менее мощный магний. В растворе (в жидкой среде) алюминий присутствует в виде ионов Al 3+, он окисляется и образует оксид алюминия Al2O 3.
В некоторых отношениях химические свойства алюминия необычны по сравнению с другими металлами. Например, металлы редко реагируют как с основаниями, так и с кислотами. Это важный фактор, когда алюминий используется в качестве емкости для жидкостей. Необходимо следить за тем, чтобы алюминий не растворился. По этой причине банки для напитков имеют тонкий внутренний слой для предотвращения коррозии.
Еще одним любопытным фактом об алюминии является то, что он не только порошкообразный, но и непирофорный. Это означает, что алюминий в виде порошка очень огнеопасен и считается опасным, особенно во время обработки, при которой часто образуются мелкие частицы пыли.
Тот факт, что алюминий так легко соединяется с кислородом, оказывает непосредственное влияние на сварочные процессы. Слой твердого оксида, образующийся на поверхности алюминия, плавится при температуре, в три раза превышающей температуру нижележащего алюминия. Поэтому перед сваркой поверхность должна быть тщательно очищена, обычно ацетоном, а в течение всего процесса сварки требуется переменный ток.

Какие свойства проявляет алюминий в реакциях?
Чистый, легкий алюминий имеет тусклый серебристо-серый цвет, который создается тонким оксидным слоем, очень быстро нарастающим при контакте с воздухом. Пассивирующий слой делает чистый алюминий очень устойчивым к коррозии при значениях pH от 4 до 9 и имеет толщину около 0,05 мкм. Этот оксидный слой также защищает от дальнейшего окисления, но является барьером при электрическом контакте и сварке. Оно может быть упрочнено электрическим окислением (анодированием) или химическим способом.
Оксидный слой может быть растворен с помощью реакций комплексообразования. Алюминий образует очень устойчивый и водорастворимый нейтральный комплекс в нейтральном растворе хлорида. Следующее уравнение реакции иллюстрирует этот процесс:
Al2O3(s) + 2 Cl(aq) + 3 H20(l) —>2 Al(OH)2Cl(aq) + 2 OH(aq).
Предпочтительно это происходит в местах, где слой оксида алюминия уже поврежден. Коррозия возникает там в результате образования отверстий. Если раствор хлорида достигает свободной поверхности металла, происходят дальнейшие реакции. Атомы алюминия могут окисляться и образовывать комплексы:
Al(s) + 4H2O(l) + Cl (aq) —>Al(OH)2Cl (aq) + 3e +2H3O (aq).
Если в растворе присутствуют ионы более благородных металлов, они восстанавливаются и осаждаются в алюминии. На этом принципе основано восстановление ионов серебра, присутствующих в виде сульфида серебра на поверхности потускневшего серебра, до серебра. Алюминий бурно реагирует с водным раствором гидроксида натрия с образованием водорода. Эта реакция используется в химических очистителях труб.
Реакция Al с NaOH протекает следующим образом:
Шаг 1: Реакция с водой
2Al+6H2O —>2 Al(OH)3 +3 H2. Шаг 1.
За этим обычно следует сушка поверхности, что приводит к преобразованию гидроксида в оксид:
2 Al(OH)3 —>Al2O3 +3H2O
Однако это не так, когда алюминий реагирует в водном растворе едкого натра.
Шаг 2: Концентрирование гидроксида с образованием оксида алюминия натрия.
Al(OH)3 +Na +OH —>Na + Al(OH)4
Во второй фазе гелеобразный гидроксид становится водорастворимым и может быть удален с поверхности металла. Это означает, что алюминиевая поверхность больше не защищена от дальнейшего воздействия воды, и шаг 1 повторяется. Таким образом, как и в реакции алюминия с кислотами, на каждые две молекулы алюминия можно получить три молекулы газообразного водорода.
2Al+6HCI —>2 AlCl3 +3 H2
Алюминий реагирует с бромом при комнатной температуре с образованием пламени. Обратите внимание, что полученный бромид алюминия реагирует с водой с образованием гидроксида алюминия и бромистого водорода.
AIBr3 + 3H2O —>Al(OH)3 + 3 HBr
Алюминий образует амальгаму с ртутью. Когда ртуть вступает в прямой контакт с алюминием (т.е. когда слой оксида алюминия механически разрушается во время процесса), ртуть проникает в алюминий. Затем оксид алюминия вырастает под водой в виде маленькой цветной капусты. Алюминий также бурно реагирует с соляной кислотой, выделяя водород, и медленно растворяется в серной кислоте. Он пассивируется в азотной кислоте.

Какими свойствами обладают оксид и гидроксид алюминия?
Разница между гидроксидом алюминия и оксидом алюминия. Мы можем понять разницу между ними в двух аспектах: физические и химические свойства.
1. физические свойства: глинозем представляет собой белое, нерастворимое в воде, тугоплавкое твердое вещество. Гидроксид алюминия — это вид белого коллоидного материала, нерастворимого в воде и обладающего сильной адсорбционной способностью. Он может адсорбировать взвешенные частицы и различные пигменты в воде.
Химические свойства: Глинозем — типичный оксид, который не реагирует с водой, но может реагировать с кислотами и щелочами. Глинозем химически неустойчив и легко разлагается при нагревании. Он нерастворим в слабых кислотах и основаниях, но растворим в сильных кислотах и основаниях. Обычно он используется для идентификации Al(OH)3.
Приложения: Глинозем в основном используется в качестве высокотемпературного огнеупорного материала, а гидроксид алюминия применяется в различных топливных отраслях промышленности и в медицине.
Гидроксид алюминия и оксид алюминия различаются по многим параметрам, поэтому при выборе продукта следует покупать только те, которые подходят для данной отрасли промышленности.
Гидроксид алюминия является отличным представителем амфотерных гидроксидов.
Применение и использование гидроксида алюминия Глинозем — это Al2O3.
Физические свойства: Глинозем представляет собой белый аморфный порошок или очень твердые белые кристаллы. Молекулярная масса = 101,96, плотность — 3,97 г/см3, температура плавления — 2053°C, температура кипения — 3000°C.
Химические свойства: Глинозем проявляет амфотерные свойства — свойства кислотных и основных оксидов — и реагирует как с кислотами, так и с основаниями. Кристаллический Al2O3 химически пассивен, а аморфный Al2O3 более реактивен.
При взаимодействии с кислыми растворами образуются средние соли алюминия, а при взаимодействии с основными растворами образуются комплексные соли — гидроксоалюминаты металлов: При сплавлении глинозема с твердыми металлическими щелочами образуются двойные соли — мета-алюминаты (безводные соли алюминия):
Глинозем не реагирует с водой и не растворяется в ней.
Производство: Глинозем получают путем восстановления металлов из их оксидов с помощью алюминия: Хром, молибден, вольфрам, ванадий и т.д. — Металлотермия.
Используется: Глинозем используется для производства алюминия в виде порошка — для огнеупорных, химически стойких и абразивных материалов, в кристаллическом виде — для производства лазеров и синтетических драгоценных камней (рубинов, сапфиров и т.д.); окрашивается примесями оксидов других металлов — Cr2O3 (красный), Ti2O3 и Fe2O3 (синий).
Физические свойства: Гидроксид алюминия белый, аморфный (желатинообразный) или кристаллический. Почти нерастворим в воде; молекулярная масса — 78,00; плотность — 3,97 г/см3.
Химические свойства: Типичный амфотерный гидроксид реагирует: 1) с кислотами с образованием промежуточных продуктов: Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O; 2) с растворами щелочей с образованием комплексных солей — гидроксоалюминатов: Al(OH)3 + KOH + 2H2O = K. Когда Al(OH)3 плавится с сухими щелочами, образуются мета-алюминаты: Al(OH)3 + KOH = KAlO2 + 2H2O.
- Из солей алюминия под действием раствора щелочи: AlCl3 + 3NaOH = Al(OH)3 + 3H2O;
- Разложение нитрида алюминия водой: AlN + 3H2O = Al(OH)3 + NH3?;
- Барботирование СО2 через раствор гидроксокомплекса: Al(OH)4- + CO2 = Al(OH)3 + HCO3-;
- Действие на соли Al с гидратом аммиака; Al(OH)3 образуется при комнатной температуре.